
近年来,随着生物工程学等相关技术的进步,全球细胞培养肉行业取得了飞速发展,当前总体正处于从实验室到中试规模生产的过渡阶段。在生产升级中,细胞培养肉所面临的多方面挑战可归纳为成本、生产规模与产品品质3个方面:其一,得益于无血清培养基研发与细胞规模化放大等方面的技术进展,细胞培养肉成本已由首块细胞培养肉汉堡的33万美元降至每公斤50美元以下,并且仍然具有较大下降空间,目前主要受制于优质种子细胞获取效率低下、无血清培养基成本有待进一步降低等问题。其二,种子细胞贴壁依赖特性和悬浮体系中剪切力可能带来的负面效果,使得高效的细胞悬浮放大体系建立较为困难。其三,细胞培养肉产品存在口感质构与营养价值不足等问题,与传统畜牧养殖肉类相比在品质方面仍存在较大差距,组织构建材料性能不佳、细胞分化与蛋白合成效率低下可能是其关键限制因素。为此,本文围绕优质种子细胞获取、低成本无血清培养基研发、规模化放大体系建立、细胞培养肉组织化构建4个环节综述了细胞培养肉的生物工程学基础与最新研究进展,并针对关键技术挑战展开分析,进而提出潜在突破途径与未来研究方向。
1 优质种子细胞获取
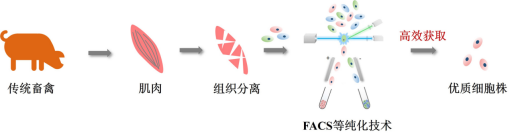
图1 优质种子细胞获取流程
1.1 肌肉干细胞高效获取
酶解法因细胞获取效率、纯度更高,故在肌肉干细胞分离中应用更为广泛。现阶段,最常用的纯化方法是流式细胞荧光分选法(FACS),其具有分选参数多、纯度高、灵活性强等优势。前期研究多以CD29+、CD56+、CD31-、CD45-分选策略纯化肌肉干细胞,而该策略存在较多杂细胞,影响肌肉干细胞成肌分化效果。新策略建立了ITGA7+、ITGA5-、JAM-1-、CD45-分选策略,连续传代3次后细胞纯度未发生显著降低。
1.2优质细胞株开发
基因编辑永生化细胞当前不适用于细胞培养肉生产,而自发永生化细胞是在长期体外培养过程中通过自然突变获得无限增殖能力,未经人为基因编辑干预,安全风险性较低,是细胞培养肉生产的优质细胞株。
2 低成本无血清培养基研发
2.1 无血清培养基设计
在无血清培养基中常以白蛋白替代血清,然而白蛋白的添加会导致无血清培养基成本增加50%~400%,以原料来源广泛、成本低廉的天然植物蛋白及其水解产物替代白蛋白,能够有效降低无血清培养基成本。
2.2 无血清关键成分生物合成
当前无血清培养基中使用的生长因子等关键成分主要由动物源分离获取,成本高昂且存在动物源生物安全风险等问题。利用大肠杆菌、酵母表达系统等工程化微生物能够实现生长因子等关键成分的低成本生物合成,还能够规避朊病毒污染等生物安全风险。此外,通过设计共表达载体构建单株微生物的生长因子联合表达系统,能够实现多种目的生长因子的高效共表达,有效降低生长因子生产成本。
3 规模化放大体系建立
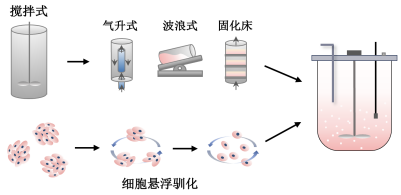
图2 种子细胞高效规模化放大体系建立
3.1 生物反应器选择
肌肉干细胞等剪切敏感种子细胞的搅拌式反应器规模化放大仍具有挑战性,搅拌桨转动带来的高剪切力可能是其关键限制因素。通过探索低剪切特性反应器,如气升式、波浪式以及固化床等反应器,能够为肌肉干细胞的放大培养提供更多可行方案。
3.2 悬浮培养体系建立
现阶段,细胞的悬浮驯化通常通过机械剪切力抑制贴壁依赖性细胞增殖,促进细胞逐步适应悬浮条件而实现。悬浮驯化能够使种子细胞在悬浮条件下以单细胞或小细胞团的形式稳定、连续、高效扩增,通过突破细胞对于贴壁面积的依赖实现易于放大的高密度细胞培养,有助于细胞培养肉规模化放大生产。
4 细胞培养肉组织化构建
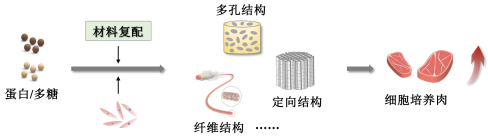
图3 高品质细胞培养肉组织化构建流程
4.1 组织构建材料优化
当前,植物蛋白材料,如大豆分离蛋白、谷蛋白和玉米蛋白等已被应用于细胞培养肉组织构建,且取得良好效果。然而,蛋白结构紧密、材料纯度低以及成型手段限制等因素而导致植物蛋白材料通常机械性能较差,难以为组织构建提供良好的质地,从而影响细胞培养肉产品的感官品质。多糖类材料,如海藻酸钠、琼脂糖、结冷胶等,具有良好的机械性能且能够在温和条件下快速成型。将多糖与植物蛋白复配用于细胞培养肉组织构建,可同时满足组织质地和细胞生长需求,通过调节多糖含量与交联度还可进一步满足不同细胞及其不同生长阶段对于基底硬度的不同需求,促进成肌或成脂分化,实现细胞培养肉口感、风味、营养价值的提升。
4.2 结构设计与组织构建
三维支架可为种子细胞提供三维生长环境,从而达到促进细胞增殖、分化的效果,且通过挤压拉丝、冷冻干燥等技术制备的支架可赋予产品一定的质地,是当前细胞培养肉组织构建最为常用的支撑结构。进一步在三维支架基础上对其微观结构进行设计,能够更好地促进细胞排列、融合以及成肌分化。通过优选组织构建材料并充分利用三维结构调控手段,促进细胞与细胞、细胞与材料之间相互作用,能够有效提升细胞成肌分化与肉类蛋白合成效率,推动细胞培养肉的高品质生产。
5 结语
本文综述细胞培养肉的生物工程学基础与最新研究进展,并针对低成本、规模化与高品质生产的关键技术挑战展开分析,提出潜在突破途径与未来研究方向:1)通过简化、标准化分离流程以及优化分选策略,提高核心种子细胞获取效率,开发兼具高效增殖、分化能力以及长期传代稳定性的优质细胞株,降低细胞培养肉生产成本。2)基于白蛋白、生长因子等成分设计,开发无血清培养基,并通过优化发酵工艺、多因子共表达等途径降低关键成分生物合成的生产成本,促进无血清培养基成本进一步降低。3)依据种子细胞生长特性选择剪切条件适宜的生物反应器,通过悬浮驯化突破细胞贴壁依赖建立规模化悬浮培养体系,推进种子细胞规模化放大生产。4)优选组织构建材料并探究材料复配策略以满足组织构建需求,通过微尺度三维结构设计提升细胞成肌分化与蛋白合成效率,推动细胞培养肉产品品质提升。
在未来研究中,更加深入地将人工智能等前沿技术与生物工程技术相结合,有助于实现细胞培养肉在生产成本、规模和品质方面的关键瓶颈问题突破。在低成本生产方面,结合机器学习与高内涵系统提高无血清培养基关键成分筛选与评估效率,通过降低无血清培养基研发成本,有助于促进细胞培养肉生产成本降低。在规模化放大方面,利用基于实时监测技术的细胞精准饲养和培养基循环利用策略,有助于推进细胞培养肉规模化与可持续性生产。在产品品质提升方面,通过肌肉、脂肪、血管等多组织共建模拟肉类组织特性,突破细胞互作与传质效率低下难题,进一步推动高品质细胞培养肉生产。随着多学科前沿技术的不断发展与交叉应用,低成本、规模化、高品质的细胞培养肉生产有望在不远的未来推动细胞培养肉真正走上餐桌,为消费者提供更加健康、环保、个性化的肉类选择。
原文链接:
https://kns.cnki.net/kcms2/article/abstract?v=NeMQ-uUh4kFcCrQ5YwQRp98UA_pigIA1addYOBaI0USmEb8JCZ7Ve-LmxK1W741E_vXzU7Ekf8G1c09CGI7DEswQ9WMTY_YnGCdmtCthzpttY-JJDA8zRWx1UpGm10eqwnvy14lqkKSJ_SiNKIlL8-yqJjgdpCGlXwzhnz6SC2xO_3C_ahK33w==&uniplatform=NZKPT&language=CH


