
随着肠道微生物群与人类健康关系研究的不断深入,益生菌在健康领域的应用受到广泛关注。作为新一代益生菌的代表,嗜黏蛋白阿克曼菌(Akkermansia muciniphila,AKK)在维持肠道屏障功能,调节免疫平衡及代谢稳态方面表现出独特的益生特性。AKK在人体肠道中占比约1%~3%,代谢黏蛋白产生短链脂肪酸参与宿主能量代谢和免疫调控。研究表明,在肥胖、2型糖尿病、炎症性肠病及神经退行性疾病等病理状态下,AKK丰度显著下降,而适量补充AKK可改善代谢紊乱,增强肠道屏障功能及缓解炎症反应。此外,基因工程工具(如CRISPR-Cas系统)及质粒载体的开发,为AKK的功能基因研究及新型益生菌制剂设计提供了重要支撑。文章综述了AKK的生物学特性、体外益生功能、疾病防控作用及基因工程策略,探讨其在健康管理和疾病干预中的潜力与挑战,旨在为AKK的精准营养应用、个性化治疗及产业化开发提供理论依据。
1. AKK概述
AKK是人类和哺乳动物肠道中一种常见的革兰氏阴性厌氧菌,无鞭毛,呈椭圆状,不运动,能够在20~40℃和pH 5.5~8.0条件下生长,最适生长环境为37℃,pH 6.5。AKK具备一定的耐氧能力,暴露于空气中48 h仍具有活性。AKK以黏蛋白作为唯一的碳源和氮源,主要代谢产物为乙酸和丙酸。此外,AKK与肠道共生菌群的互作已被证实对维持宿主代谢稳态和屏障功能具有积极影响。研究表明,无论是活菌还是巴氏灭菌的AKK,在1010CFU/d剂量下口服摄入均具有良好的安全性。2021年,欧洲食品安全局(European Food Safety Authority,EFSA)对巴氏灭菌的AKK安全性给予肯定评价,其标志着新一代益生菌的应用前景。深入解析AKK的定植部位、丰度和功能,为治疗干预和开发新型基因工程菌株提供关键依据,为促进整体健康开辟了新的途径。
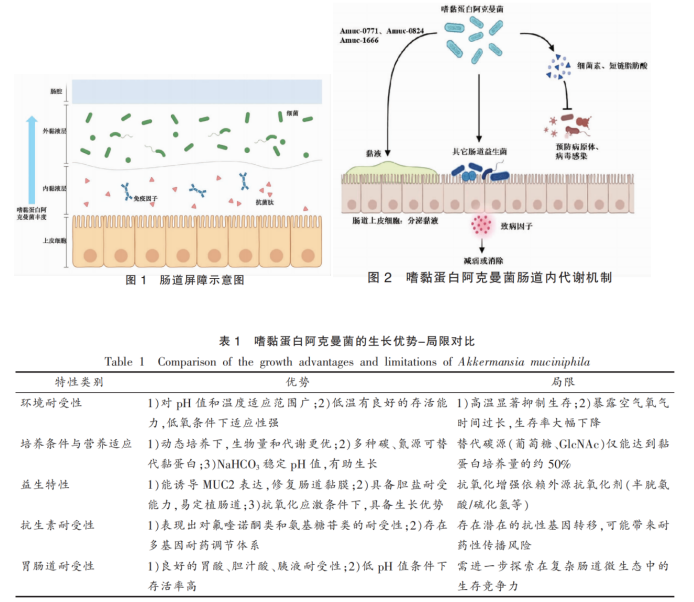
2. AKK与疾病的关联性
2.1 AKK与胃肠道疾病
慢性肠道炎症是多种慢性炎症性疾病的共同病理特征,通常会导致肠道屏障损伤和菌群失调。炎症性肠病(Inflammatory bowel disease,IBD),包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),是典型的慢性免疫介导疾病,其发病机制与肠道微生态失衡密切相关。常见的其它胃肠道疾病还有肠易激综合征(Irritable bowel syndrome,IBS)、结直肠癌(Colorectal cancer,CRC)等。在IBD患者中,AKK肠道丰度显著下降,推测其可能具有调控炎症信号通路与免疫细胞活性,进而具有抗炎的作用。在青少年CD患者肠道中,AKK水平显著低于对照组,推断其可能是辅助儿科CD诊断的潜在生物标志物。CD患者和UC患者的AKK定植和丰度显著降低,经过洗涤菌群移植(Washed microbiota transplantation,WMT)治疗后,患者的AKK定植率显著回升。
AKK可增强肠黏蛋白屏障,抑制NLRP3炎症小体活化,从而缓解葡聚糖硫酸钠(Dextran sulfate sodium,DSS)诱导的结肠炎,其免疫调节活性不仅局限于菌体,而且部分免疫调节活性由其外膜成分介导,例如:其外膜蛋白Amuc_1100已被证实可通过TLR2信号途径改善屏障功能。AKK能够诱导初始CD4+T细胞重编程为调节性T细胞(Tregs),从而限制结肠炎的发展。AKK的胞外囊泡(AmEVs)由脂质、蛋白质等组成,通过改变紧密连接蛋白(如Occludin、Zonula occludens和Claudin-5)的表达,增强肠道屏障功能,在高脂饮食模型中,显著提升屏障完整性。这些研究结果为基于AKK的治疗策略提供了理论依据。
2.2 AKK与代谢综合征
近年来,肠道微生物群在肥胖发生、发展中的关键作用得到广泛关注。肥胖是由能量摄入超过消耗所引起的慢性代谢性疾病,通常伴随高血糖、高血脂、高血压等代谢综合征。多项临床和动物实验表明,AKK的丰度与肥胖及代谢异常状态呈显著负相关,在高脂饮食或遗传性肥胖小鼠模型中,AKK丰度可下降百倍以上。补充活性或巴氏消毒处理的AKK可显著减缓体质量增长,减少脂肪堆积,改善胰岛素抵抗和脂质代谢紊乱,并通过增强肠道屏障,降低炎症水平和调节脂多糖介导的代谢性内毒素血症,改善代谢稳态。此外,AKK可通过促进GLP-1分泌,上调脂肪组织能量消耗相关因子,抑制肠道碳水化合物吸收等机制,参与能量代谢调控。
全球糖尿病发病率持续上升,预计至2040年将超过6.42亿人。肠道菌群失衡被认为与糖尿病等代谢疾病的发生密切相关。糖尿病本质上是一种以慢性高血糖为特征的代谢紊乱,主要由胰岛β细胞胰岛素分泌不足或外周组织的胰岛素抵抗引起。在1型糖尿病(T1D)患者中,AKK丰度显著下降,补充AKK可增强肠道屏障,上调抗菌肽,抑制致病菌定植及毒素释放,从而延缓T1D的发展。2型糖尿病(Type 2 diabetes,T2D)与肥胖密切相关,临床研究发现T2D患者普遍伴随AKK丰度降低,菌群多样性下降及病原体增加。Zhang等通过T2D-NO(新诊断的2型糖尿病且体质量正常)组与NGT-NO(正常葡萄糖耐量且体质量正常)对照组的临床试验发现,T2D-NO组AKK丰度显著降低,且其丰度与胰岛素分泌呈正相关。动物实验进一步证实,补充AKK可逆转饮食诱导的AKK缺乏,提升胰岛素分泌和葡萄糖耐受性,改善代谢紊乱。AKK作为候选益生菌在糖尿病和肥胖的干预中显示出潜力,然而,其疗效和安全性仍需临床验证。
2.3 其它疾病
除代谢综合征及胃肠道疾病外,AKK在多种慢性疾病和病理状态中也展现出广泛的干预潜力(图4)。在心力衰竭和其它心血管疾病中,AKK的丰度与疾病严重程度呈负相关。研究表明,AKK可通过降低促炎代谢产物水平,维持肠道屏障完整性,调控免疫细胞功能,间接缓解心血管炎症反应,其代谢产物,尤其是短链脂肪酸,亦被证实可改善脂质代谢,降低心血管风险。
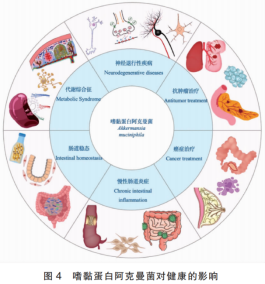
在神经精神系统疾病中,AKK同样具有积极影响。研究表明,在自闭症谱系障碍(Autism spectrum disorder,ASD)、阿尔茨海默病(Alzheimer's disease,AD)、帕金森病(Parkinson's disease,PD)及抑郁症等患者中,AKK丰度相较正常人群降低。在AD和轻度认知障碍患者中,补充AKK可通过调节肠道菌群组成与代谢物水平,减轻脑内β-淀粉样蛋白沉积,改善认知功能缺陷,结果揭示了AKK在肠-脑轴层面的神经保护潜力,然而,其是否能直接干预PD相关的认知障碍,目前仍缺乏确凿证据。此外,在肿瘤疾病中,AKK被认为可能具有增强免疫检查点抑制剂的疗效,并调节肿瘤微环境。已在乳腺癌及其它实体瘤模型中初步证实其调节作用。综上,AKK不仅在代谢综合征及胃肠道疾病中表现出良好的预防与治疗前景,还可能成为包括心血管疾病及神经退行性疾病在内的多种慢性病的辅助干预靶点。未来应通过深入的机制研究和临床试验,进一步明确其作用机制及临床应用价值。
3. AKK基因工程的技术展望
基因改造技术是一个跨学科的研究领域,包括基因功能研究、模型生物开发、表观遗传学多个领域。成簇规律间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)及其相关蛋白(Cas)技术以其高效和便携特性,在益生菌领域取得显著进展。随着对AKK在肠道健康中作用的深入了解,建立一个高效的遗传操作系统显得尤为重要。由于AKK在遗传操作上的难度,因此对其功能基因和代谢途径的理解一直受限。目前有研究发现AKK能够耐受微量的氧浓度,这项发现增加了AKK用来进行转基因研究的可能性。CRISPR-Cas9等基因组编辑技术的发展,为AKK的遗传操作提供了新的工具和方法。通过CRISPR-Cas9技术,可以实现对AKK基因的精确编辑,包括基因敲除、基因突变、基因敲入和基因调控等。
3.1质粒工具的发展与功能拓展
质粒是微生物遗传操作的关键工具,主要作为基因载体使用。质粒携带外源基因,并在细胞分裂过程中稳定地传递给子代细胞,从而确保遗传操作的连续性和可靠性。AKK天然转化效率低,缺乏可用质粒系统,限制了其功能解析和遗传改造。目前常用的质粒导入方式包括热激、电穿孔和接合转移,然而在AKK中的适用性有限。2020年,Ogata等从成年日本男性中筛选出1株AKK,并将其命名为Akkermansia muciniphila JCM 39803,在该菌株中,研究人员首次发现了内源性质粒。2023年,Davey等发表了关于AKK首套遗传操作系统的研究方法。该研究并未采用传统的电穿孔方法,而是构建了大肠杆菌-AKK接合转移方法。这些研究成果为AKK质粒的构建和其它遗传操作元件的筛选提供了重要的理论依据,并为深入开发遗传操作方法奠定了基础。
3.2 CRISPR系统在AKK中的应用潜力
CRISPR-Cas系统通过CRISPR RNA(crRNA)引导Cas蛋白精确识别并结合到目标DNA的特定序列上,Cas蛋白激活其核酸酶活性,切割DNA双链,实现对特定基因位点的精确编辑。近年来,CRISPR/Cas9系统在益生菌基因敲除中被广泛使用,解析特定的基因功能或改善菌株特性。例如,张莹等建立了适用于干酪乳杆菌的基因编辑系统——CRISPR/Cas9D10A系统,为乳酸菌过表达提供了新的工具。2025年,Tamaki等建立并优化了副干酪乳酸杆菌CRISPR/Cas9基因组编辑系统,为基因编辑提供了可行的优化方法,为遗传功能机制的研究奠定了基础。Passel等通过对AKK进行完整基因组测序,发现了CRISPR位点,推测AKK的CRISPR系统可以通过CRISPR-Cas9技术进行改造和优化。
4. 结论与展望
AKK在维持肠道屏障功能和宿主健康方面具有重要作用,在肥胖、炎症性肠病、2型糖尿病等代谢性疾病的治疗中展现出潜在益生作用。AKK的耐胆盐、氧气耐受和耐药性使其成为理想的下一代益生菌。基因工程工具(如CRISPR-Cas系统)的发展为AKK的精确改造提供了可能,有助于开发新的治疗策略。目前研究显示,虽然适当剂量的AKK对人类安全,但是其长期使用和不同人群中的安全性和有效性仍需更多临床试验验证。未来需深入探索AKK的生理功能和作用机制,开发高效遗传操作方法,以增强其益生特性或赋予新功能。随着研究的不断深入,AKK可能成为未来个性化医疗和精准营养的重要组成部分。
原文链接:https://kns.cnki.net/kcms2/article/abstract?v=bugI047JRxgt_Z4CGTMPN3XVCvaHM6jvhx4yYBDoeqg255P_6YC7ZNK1c1-esHg1eQPTvlbzDWtpsc_qvDx-1XOMYSnScrmZ2RwKJKcXwpxrqepiX9TY-IzTafSUMKSP6hlLpHDGryD4OXnxbnM3PajF_EA5uu9k9P4o-FnNjBlYjbwYn0U6lw==&uniplatform=NZKPT&language=CHS


